GenVaxell 基质胶
GenVaxell 基质胶由EHS 小鼠肿瘤中提取出来的可溶性基底膜制备。在室温条件下,聚合形成具有生物学活性的三维基质,模拟体内细胞基底膜的结构、组成、物理特性和功能,有利于体外细胞的培养和分化,可促进上皮细胞、肝细胞、塞尔托利氏细胞、黑色素瘤细胞、血管内皮细胞、甲状腺细胞及毛囊细胞等的贴壁与分化。可用于对细胞形态、生化功能、迁移、侵袭和基因表达等的研究。
GenVaxell 基质胶可用作多种肿瘤细胞侵袭研究的基本支架、体内外血管新生研究的基质及体内动物模型移植瘤细胞生长的三维支架;还能支持外周神经的新生和牛输卵管上皮细胞的分化。
基质胶具备以下功能:
对正常和变换的锚定依赖型上皮样细胞和其他细胞类型的附着和分化是有效的,这些细胞类型包括神经元、肝细胞、支持细胞、小鸡晶状体上皮细胞和血管内皮细胞;
可以影响在成年大鼠肝细胞、血管内皮细胞以及小鼠和人乳腺上皮细胞的三维细胞培养中的基因表达,该功能是这几种类型肿瘤细胞侵袭实验的基础;
可以支持体内末梢神经再生,并提供体外和体内血管再生研究的必需底物;
支持免疫抑制小鼠中体内人类肿瘤的增殖;
能用于未分选乳腺细胞的移植以及分选的上皮细胞亚群嵌入基质胶,这一机制也被用于癌症干细胞模型并被证明能在体内增强肿瘤生长速率。
GenVaxell 基质胶为无菌制品,分为以下几种类型:
标准型基质胶:浓度范围大致为8-12 mg/ml;
高浓度基质胶:浓度范围大致为18-22 mg/ml;
无酚红基质胶:不含酚红,产品完全融化后颜色透明;
生长因子减量型基质胶:基质胶里包含的生长因子经过减量处理;
人胚胎干细胞专用基质胶:经过对hESC 培养的测试,可以用于人胚胎干细胞的培养;
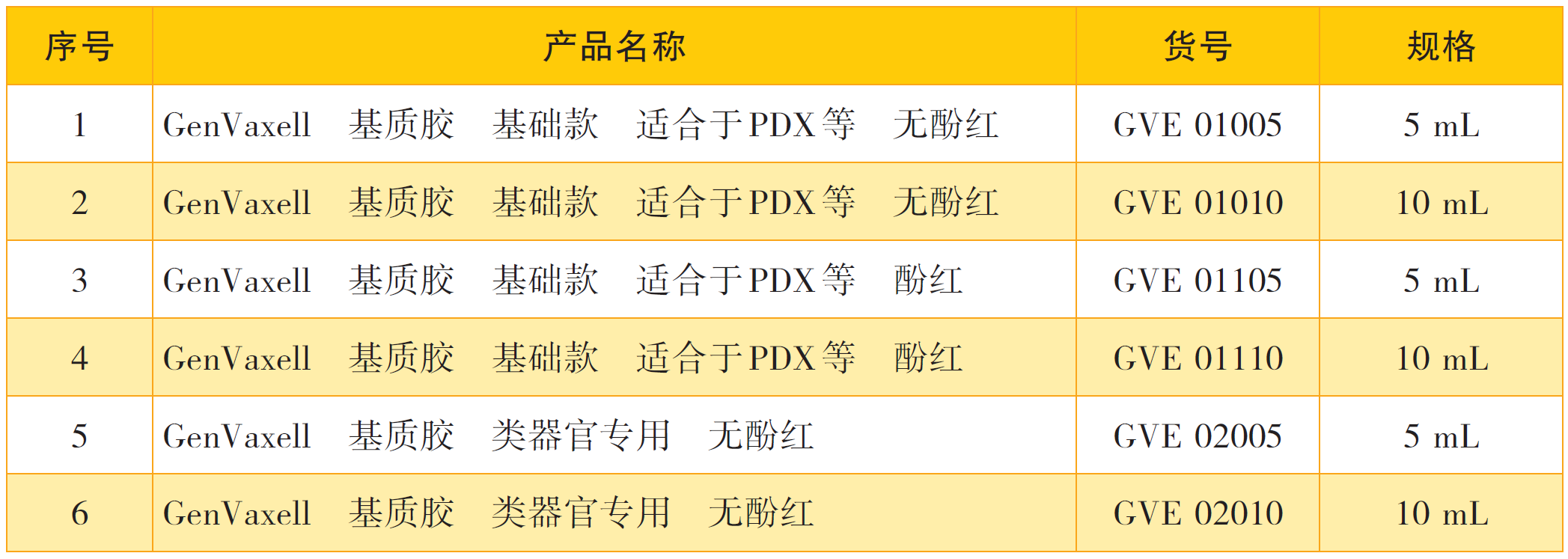
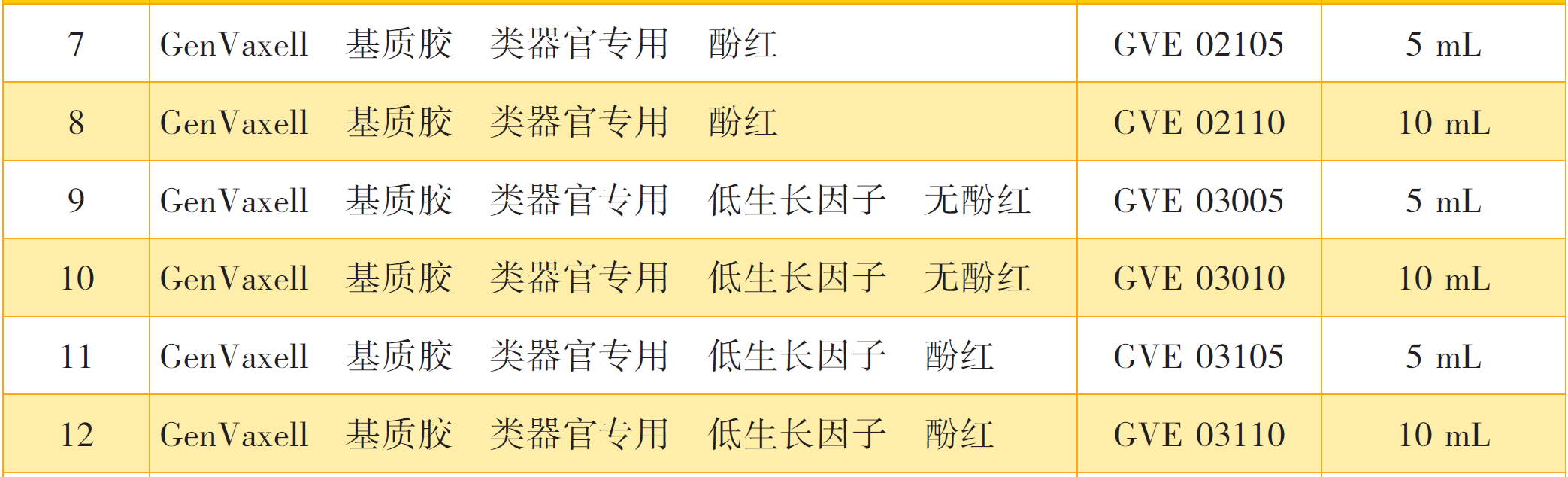
产品目录:
基质胶使用方法:
GenVaxell 基质胶推荐使用浓度:
凝胶浓度:在需要基质胶凝胶的实验中,工作浓度需大于3 mg/mL;
包被浓度:包被实验时基质胶无需成胶,因此包被浓度应小于凝胶浓度(即3 mg/mL);
工作浓度:需要根据具体的细胞类型进行预实验测试。对于侵袭实验,建议初始浓度设置在200-300 μg/mL 之间,再根据特定的实验体系进行优化;
血管生成实验浓度:请务必使用大于10 mg/mL 的基质胶产品,GenVaxell 提供挑选批次和批次预留的服务,请您在订购产品时向代理商说明您的要求;
体内皮下注射实验浓度:由于是体内实验,为了避免成胶不完全,建议终浓度在4 mg/mL 以上;
1.GenVaxell 基质胶的融化与保存
(1) 第一次使用,将整瓶GenVaxell 基质胶放入冰盒内再放到4℃过夜,使其充分融解;
(2) 吸头与试管提前预冷,剩余基质胶分装后-20℃冻存(避免反复冻融)。
2.薄胶制备
(1) 基质胶完全融化后,用预冷的枪头混匀;
(2) 将培养板置于冰上,按50 μL/cm2的量注入GenVaxell 基质胶;
(3) 37℃放置30 min,此时平板即可使用。
3.厚胶制备
(1) 基质胶完全融化后,用预冷的枪头混匀;
(2) 将培养板置于冰上,提前将培养的细胞与稀释后的基质胶混合,用遇冷的枪头使细胞悬浮均匀。按照150-200 μL/cm2的量注入GenVaxell 基质胶;
(3) 在37℃放置30 min,此时即可加入细胞培养液。细胞也可生长在此厚胶的上层。
4.薄层包被
(1) 基质胶完全融化后,用预冷的枪头混匀;
(2) 用无血清培养基稀释GenVaxell 基质胶,建议根据具体的实验做梯度实验,从而确定最佳的包被浓度。(为了保证GenVaxell 基质胶的成胶性能与稳定性,最终稀释浓度不应低于3 mg/mL);
(3) 将稀释的GenVaxell 基质胶加入需要包被的培养器皿中,包被量至少覆盖细胞的所有生长表面。室温下孵育1 小时;
(4) 用无血清培养基轻轻地冲洗掉未凝固结合的基质胶,此时平板即可使用。
备注:GenVaxell 基质胶包被的平板建议当天使用;包被好的平板加入培养基后,在37℃最久可存放1 周。保存时培养表面需要保持湿润,请勿将包被工作液从培养器皿中吸出。(稀释后未用完的基质胶不建议保留再用)。
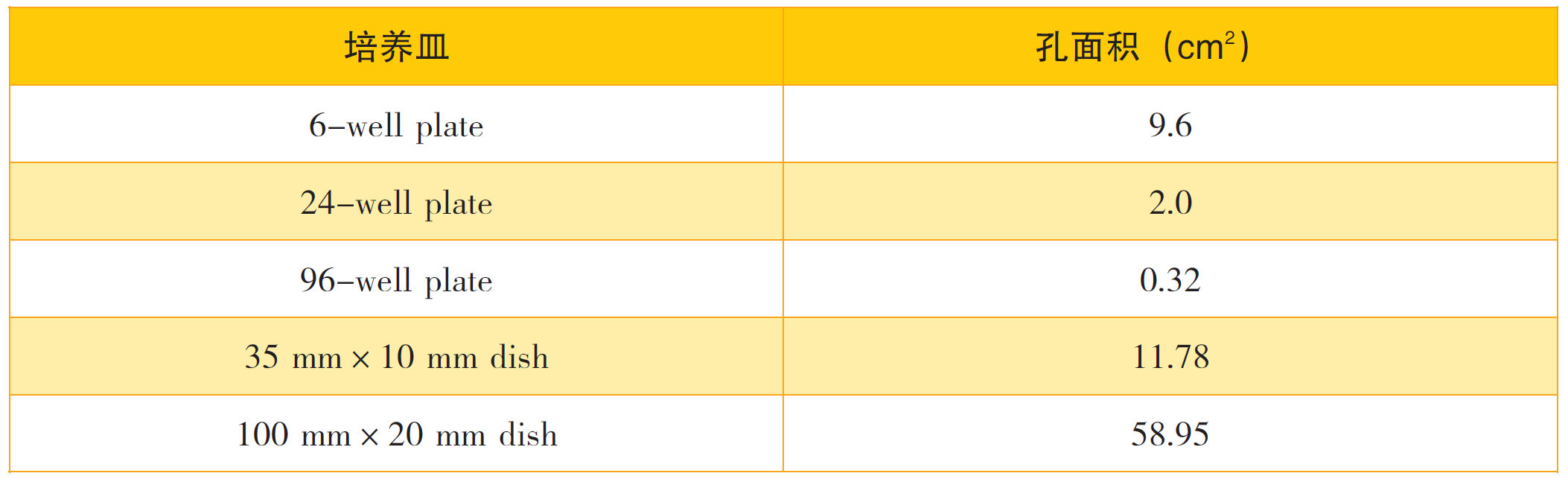
各培养皿的有效面积参考下表:
注意事项:
基质胶的分装、使用等操作需在无菌环境下进行。在实验的全部过程中请保持GenVaxell 基质胶处于冰上;
由于基质胶在10℃以上会开始凝胶化,因此所有与基质胶接触的培养皿、培养基、枪头、产品管等都应提前预冷;
GenVaxell 基质胶短期保存置于-20℃,长期保存置于-80℃;
基质胶在第一次融化后进行分装,避免反复冻融;建议分装后保留瓶子的标签或记录下货号及批次号,以便后续查询追踪相关信息;
基质胶融化过程需将整瓶埋没在碎冰盒中,再将冰盒置于4℃冰箱中过夜。建议放在冰箱靠后的位置,请勿将基质胶直接放在4℃冰箱中融化,也勿将冰盒放在冰箱门上或靠门的位置;
本产品仅供科研使用,禁止用于人体;穿实验服并戴一次性手套。
基质胶使用常见问题:
1.基质胶小瓶冻融过程中为什么会发生颜色的变化?
颜色的变化是正常的,由于二氧化碳和碳酸氢盐缓冲液以及酚红的作用,颜色会从淡黄变化到深红色。颜色变化不会影响产品的功效,在5%CO2平衡下颜色会恢复。
2.基质胶颜色为什么会有不一样?
无酚红基质胶没有颜色,完全融化后应是透明的;含酚红基质胶颜色可以在明黄色至暗红色之间变化,这些颜色变化是正常现象。因为酚红存在时,在温度、pH 不同的情况下液体会出现颜色的差异。
3.为什么基质胶融化时发现有凝胶,不能完全融化?
基质胶对温度非常敏感,超过10℃即开始成胶,超过22℃成胶速度会更快。如果到货情况正常,出现此种现象应该是融化操作不规范或者融化期间环境温度升高导致部分凝胶。请一定严格按照融化操作规范执行,确保融化时整瓶完全置于低温环境。
4.什么是稀释因子(Dilution Factor)?
对于干细胞专用型基质胶,其COA 中不包含浓度说明,但是有稀释因子说明。稀释因子的数值也是批次特异性的,每个批次的稀释因子是根据蛋白质浓度计算的。可以按照稀释因子的数值来确定使用的量。比如某一批次的稀释因子为238 μL,则可将238 μL 的hESC-qualified 基质胶原液加入到25 ml DMEM/F12 中,混匀后可铺4 块六孔板,每孔使用1 mL 基质胶稀释液进行包被。具体实验步骤可见相应COA 文件。
5.凝胶后的基质胶能否融化后再使用?
基质胶一旦成胶,是很难完全恢复的。可以尝试将基质胶埋在碎冰中,放入4℃冰箱,24-48 小时后观察能否融化。请注意,对于该处理方式后融化的基质胶,其性能是无法保证的。
6.侵袭实验中,基质胶铺板几个小时,为什么不会成胶?
在侵袭实验中,使用基质胶的目的是包被小室表面,形成一层基质蛋白薄膜来模拟细胞外基质,其使用浓度小于3 mg/mL,没有达到成胶浓度,是不会成胶的。
7.如何区分包被和凝胶?
包被指基质胶浓度小于成胶浓度(即<3 mg/mL),在细胞培养器皿表面形成薄薄的蛋白层而不凝成胶冻状物质;凝胶指基质胶浓度大于等于成胶浓度(即≥3 mg/mL),在细胞培养器皿表面能够形成胶冻状物质。